La
ciencia ha abierto una puerta a la esperanza para que aquellos que han perdido
la fertilidad tras haber sufrido un cáncer puedan recobrarla. Los tratamientos
oncológicos pueden afectar a la capacidad de los hombres para tener hijos y,
hasta ahora, la única posibilidad existente era que, antes de someterse a
ellos, dejaran una muestra de semen en un banco de esperma que se pudiera utilizar
después. Sin embargo, un equipo de investigadores de la Universidad de
Pittsburgh (Pensilvania, EE.UU.) ha logrado experimentar con éxito en primates
una alternativa.
Se
trata de una inyección de células madre previamente congeladas y capaces de producir
esperma y que, según las pruebas realizadas en los simios, consiguen fertilizar
óvulos para generar embriones. Los resultados de su trabajo se publicaron ayer
en la revista especializada «Cell Stem Cell».
Problema
en los más jóvenes
Algunos
fármacos para el cáncer actúan destruyendo las células que se dividen muy
deprisa y, como no es posible diferenciar entre las cancerígenas y otras, estos
tratamientos se pueden llevar por delante aquellas encargadas de la «fabricación»
del esperma, con lo cual dejan al paciente infértil. Según explica Kyle Orwig,
del departamento de Obstetricia, Ginecología y Medicina Reproductiva de la Pitt
School of Medicine y del Instituto Magee-Womens, «los hombres pueden almacenar
esperma antes de someterse a un tratamiento contra el cáncer si esperan tener
hijos biológicos en el futuro, pero los chicos jovenes que aún no han llegado a
la pubertad no cuentan con esa opción, ya que no pueden aportar muestras de
semen, y están muy lejos aún de pensar en tener niños».
Sin
embargo, incluso estos jóvenes impúberes tienen lo que se denomina «células
madre espermatogoniales» en su tejido testicular, preparado para empezar a
producir esperma durante la pubertad. El doctor Owig y su equipo, para
comprobar si era posible recuperar la fertilidad utilizando estas células,
practicaron biopsias en testítuculos de macacos adultos y en otros que no habían
alcanzado la pubertad y congelaron las células de las pequeñas muestras
obtenidas. A continuación, les sometieron a tratamientos con quimioterapia de
los que se sabe que anulan la fertilidad.
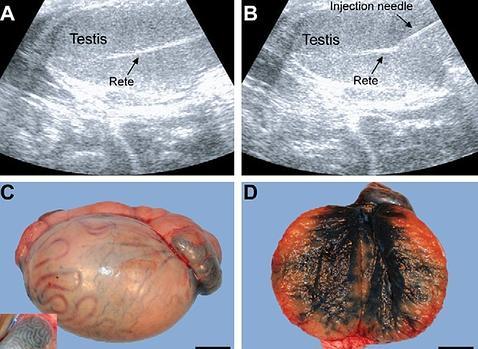
Pocos
meses despúes, los investigadores reintrodujeron a cada mono sus propias células
madre espermatogoniales en los testículos usando una técnica guiada por
ultrasonido y la producción de esperma a partir de las células trasplantadas se
estableció en nueve de doce animales adultos y en tres de cinco impúberes una
vez que alcanzaron la madurez.
Pero
los investigadores aún fueron más allá. En otra prueba, células madre
espermatogoniales de unos monos fueron trasplantados a otros animales infértiles
con los que no tenían nada que ver, que crearon esperma con la huella de ADN
del donante, con lo cual se pudo seguir la pista de su origen. En el
laboratorio, el esperma de los receptores del trasplante fertilizaron con éxito
81 óvulos, llegando los embriones que desarrollaron hasta las etapas de «mórula»
y «bastocisto», que normalmente preceden a la implantación en el útero de la
madre. El parentesco con el donante fue confirmado en siete de los embriones.
Esto
demuestra, según Kyle Orwig, que «las células madre espermatogoniales de
primates superiores pueden ser congelados y descongelados sin perder su
actividad» y que «pueden ser trasplantados para producir esperma funcional
capaz de fertilizar óvulos y dar lugar a embriones tempranos».
Almacenamiento
de tejido
En
la actualidad, ya se está almacenando tejido testicular de chicos en distintos
centros de Estados Unidos y otros países, ante la expectativa de que nuevas
terapias basadas en células madre se les pueda aplicar en el futuro para que
logren tener sus propios hijos biológicos. «Estos pacientes y sus familias son
los pioneros que inspiran nuestra investigación y ayudan a desarrollar nuevos
avances médicos», explica el doctor Orwig.
Sin
embargo, el propio investigador reconoce que todavía «quedan muchas preguntas
por contestar». «¿Debemos reintroducir las células espermatogoniales tan pronto
como termine el tratamiento, esperar hasta que el paciente se considere curado
de su enfermedad, o hasta cuando esté preparado para formar una familia?», se
pregunta. Además, «¿cómo eliminamos el riesgo de la reaparición del cáncer si
volvemos a meter células no tratadas que puedan incluir células cancerígenas?»,
plantea también. A su juicio, estos son aspectos en los que aún debemos
trabajar, pero este estudio nos demuestra que el concepto es factible».
Kyle
Orwig dirige el programa de Preservación de Fertilidad en Pittsburgh, en el que
colaboran el Instituto de Investigación y el Hospital Magee-Womens y el
Hospital Infantil y el Instituto del Cáncer de la Universidad de Pittsburgh.
Con él se ofrece educación y opciones de tratamiento para niños y adultos en
riesgo de llegar a ser infértiles debido a problemas, entre ellos el cáncer.
Ref:
Haz click aquí
No hay comentarios:
Publicar un comentario