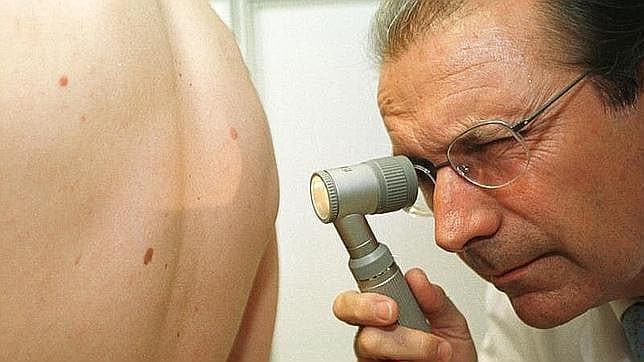
Aunque
el uso de la inmunoterapia en cáncer apenas a llegado a un pequeño número de
pacientes, su posible impacto en el futuro es lo que la convierte a ojos de los
editores de Science en el avance científico de 2013. ¿Por qué? A su juicio, los
prometedores resultados de diferentes ensayos clínicos realizados, en los que
los tratamientos tuvieron como diana el sistema inmunológico en vez de los
tumores, son suficientes para que ocupe esta posición. «Ha habido unanimidad
sobre el inmenso potencial de la inmunoterapia en cáncer», señala Tim
Appenzeller, editor en jefe de Science. «Hasta ahora, la estrategia de emplear
el sistema inmunológico para atacar tumores solo funciona en algunos cánceres y
unos pocos pacientes, por lo que es importante no exagerar los beneficios a
corto plazo. Pero muchos especialistas en cáncer están convencidos de que nos
encontramos ante el nacimiento de un importante nuevo paradigma para el
tratamiento del cáncer».
De
la misma manera piensa Marisol Soengas, directora del Programa de Patología
Molecular del Centro Nacional de Investigaciones Oncológicas (CNIO). «Aunque es
un concepto del siglo pasado, este año la inmunoterapia ha demostrado su
potencial, especialmente en tumores resistentes, como el melanoma metastático o
el cáncer de pulmón». Y también el Director del Centro Integral Oncológico
Clara Campal (CIOCC), Manuel Hidalgo, que está totalmente de acuerdo con la
decisión de los editores de Science: «tras muchos años de investigación en
inmunoterapia los datos recientes son muy alentadores», asegura el también
Director del Programa de Investigación Clínica del CNIO.
Varios
de los avances actuales en el campo de la inmunoterapia se cimentaron en los años
80, cuando investigadores franceses identificaron un receptor en las células T,
llamado CTLA-4. James Allison, ahora en la University of Texas-Anderson Cancer
Center, de EE.UU., descubrió que dicho receptor «frenaba» a las células T para
que no «atacaran» a las células invasoras con todo su potencial. Y ya a
mediados de los 90, Alison mostró que el bloqueo del CTLA-4, quitaba dicho
freno, y eliminaba los tumores en ratones. «Empezamos a considerar la
inmunosupresión como el punto diana, y la manipulación de la inmunosupresión
como el objetivo», señala Allison.
Resultados
sorprendentes
Mientras
tanto investigadores japoneses habían identificado otro «freno» en las células
T, el PD-1. Aunque no estaban pensando en el cáncer, otros sí lo hicieron. Uno,
el oncólogo de Drew Pardoll en la Universidad Johns Hopkins, se reunió con un
directivo de la biotecnológica Medarex, y le instó a iniciar un ensayo clínico.
El primero se realizó en 2006 en 39 pacientes y cinco diferentes tipos de cáncer,
y en 2008, los médicos quedaron «impresionados» por los resultados: en cinco de
los voluntarios, todos ellos con enfermedad refractaria, los tumores se habían
reducido y su supervivencia se prolongaba mucho más allá de lo imaginado.
No
fue hasta 2011 cuando se constató que la inmunoterapia iba a ser «diferente» a
otras formas de tratar el cáncer. Ese año, Bristol-Myers Squibb, que había
comprado Medarex, informó que los pacientes con melanoma metastático tratados
con este anticuerpo vivieron un promedio de 10 meses, en comparación con los 6
meses de los que no fueron tratados con inmunoterapia. Era la primera vez que
el tratamiento había prolongado la supervivencia en el melanoma avanzado en un
ensayo clínico. Casi un cuarto de los participantes sobrevivieron al menos 2 años.
Otra
área de interés en la inmunoterapia involucra la modificación genética de células
T para convertirlas en la «diana» de tumores. En 2011 esta estrategia, conocida
como terapia antigénica quimérica o terapia CAR, «revolucionó» el campo de
investigación de cáncer y ahora es el sujeto de numerosos ensayos clínicos,
especialmente en cánceres de sangre. Por ello, muchas compañías farmacéuticas
que no querían tener nada que ver con la inmunoterapia hace años ahora están
invirtiendo en este campo.
Sin
embargo las células T de ingeniería siguen siendo un campo muy experimental,
mientras que toma delantera el de los anticuerpos. Al menos cinco grandes compañías
farmacéuticas están desarrollando anticuerpos. En 2011, las autoridades
sanitarias de EE.UU. (FDA) aprobaron el ipilimumab, un anti-CTLA-4, para el
melanoma metastático. Aunque el fármaco es muy caro -la empresa cobra 120.000$
por tratamiento-, los resultados son buenos. En 2011 la compañía informó que de
1.800 pacientes con melanoma tratados con ipilimumab, el 22 % estaba vivo a los
3 años, y la combinación de ipilimumab y un fármaco anti-PD-1 lograba «una
regresión del tumor profunda y rápida» en casi un tercio de los pacientes con
melanoma. «La inmunoterapia ha logrado que en un 20-30% de los pacientes con
melanoma metastático incrementen su supervivencia más allá de los tres»,
reconoce Soengas.
Para
los médicos, acostumbrados a perder todos los pacientes con enfermedad
avanzada, los datos son muy esperanzadores. El paso siguiente es identificar
biomarcadores que podrían ofrecer respuestas y trabajar en idear vías para
hacer las terapias más potentes. En este sentido, señala Soengas, el CNIO ya
tiene un compuesto que parece «mejorar lo ya existente» y se ha planteado un
ensayo clínico para 2014.
En
cualquier caso, aunque es probable que algunos cánceres no cedan a la
inmunoterapia hasta dentro de muchos años, una cosa sí es cierta: «un libro se
ha cerrado, y uno nuevo se ha abierto. ¿Cómo va a terminar?, esto es una incógnita».
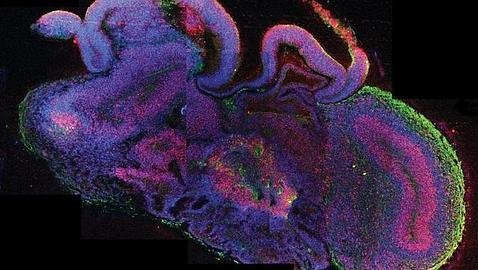
Fabricando
miniórganos
La
posibilidad de fabricar miniórganos no es ya ciencia ficción. En 2013 se han
fabricado minicerebros y minirriñones en el laboratorio. El equipo del
austriaco Juergen Knoblich, logró por primera vez obtener en el laboratorio
pequeños cerebros del tamaño de un guisante que reflejan de forma bastante fiel
las primeras etapas del desarrollo del cerebro humano. Este «fascinante»
trabajo, como le calificaron varios científicos internacionales, ha dado ya su
primer fruto: un minicerebro a partir de células madre pluripontentes inducidas
(IPs) de un paciente con microcefalia, un grave trastorno del desarrollo que
reduce el tamaño del cerebro, que han logrado corregir «in vitro».
Dicho
«organoide cerebral» se ha obtenido a partir de un cultivo de tejido de células
madre pluripotentes humanas que, lejos de reordenarse de forma caótica, se
agrupan formando una estructura esférica que recapitula en parte las primeras
etapas de la organización del cerebro humano y en concreto de la corteza
cerebral. Este trabajo puede ayudar a superar algunas de las limitaciones
actuales del estudio de las enfermedades neurológicas utilizando modelos
animales, como los ratones, que no comparten la complejidad del cerebro humano
y han demostrado ser peores predictores del resultado posterior de los fármacos
en pacientes humanos.
Otro
equipo del Centro de Medicina Regenerativa de Barcelona (CMRB) también fabricó
a partir de unas pocas células de la piel un minirriñón humano por obra y
gracia de la medicina regenerativa. Este «milagro» científico fue posible
gracia al uso de células madre embrionarias y células iPS tras reprogramar células
humanas de la piel de dos pacientes aquejados de una enfermedad renal que
provoca la aparición de quistes en el riñón.
Estos
órganos humanos miniaturizados podrían ser mejores modelos para estudiar la
enfermedad humana de lo que son los animales.
Clonación
de embriones humanos
Después
de más de una década de intentos fallidos, finalmente funcionó. Este año, los
investigadores anunciaron que habían clonado embriones humanos y los habían
utilizado como fuente de células madre embrionarias, un objetivo largamente
buscado. Capaces de convertirse en cualquier tejido y con una coincidencia genética
perfecta con la célula de la que se clonó, las células madre embrionarias podrían
ser una poderosa herramienta para la investigación y la medicina.
La
técnica de clonación, llamada transferencia nuclear de células somáticas es la misma
que se utilizó para clonar a la oveja Dolly hace 17 años. Los científicos
eliminaron el núcleo de un óvulo y luego fundieron el material celular restante
con una célula de la persona a ser clonada. A continuación «ordenan» mediante
señales a la célula fusionada para que inicie su división y, si todo va bien,
se desarrolla en embrión. Los científicos han utilizado esta técnica para
clonar ratones, cerdos, perros y otros animales, pero las células humanas ha
sido más difíciles.
En
el National Primate Research Center, de Oregón (EE.UU.) han llevado a cabo una
serie de ajustes para hacer más eficaz a esta en células de primates, incluidos
los humanos. La receta final ha funcionado sorprendentemente bien, produciendo
células madre embrionarias en aproximadamente uno de cada 10 intentos. Y un
ingrediente clave es la cafeína, que parece ayudar a estabilizar las moléculas
clave en los óvulos humanos delicados.
¿Qué
importancia tiene este hallazgo a largo plazo? En los últimos se ha logrado
reprogramar las células para convertirlas en células madre pluripotentes
inducidas (iPS), lo que evita la necesidad de usar óvulos y embriones humanos.
Sin embargo, algunos experimentos han sugerido que, al menos en ratones, las células
madre embrionarias obtenidas a partir de embriones clonados pueden ser de mejor
calidad que las células iPS.
El
hallazgo también planeta importantes dilemas éticos. ¿Podemos clonar bebés? Según
los investigadores de Oregón esa posibilidad parece poco probable: ninguno de
sus embriones clonados de monos ha logrado un embarazo en las hembras.
Biología
Estructural al servicio del diseño de vacunas
Durante
décadas los investigadores han tenido la esperanza de que la biología
estructural -el estudio a nivel del átomo de las moléculas que componen los
organismos vivos- ayudaría a diseñar mejores vacunas. Investigadores del
Instituto Nacional de EE.UU. de Alergias y Enfermedades Infecciosas (NIAID), ha
dado por fin ese paso de «gigante» para diseñar una vacuna contra el virus
respiratorio sincitial (VRS ), que hospitaliza a millones de bebés cada año y
que mata en todo el mundo a 160.000 niños al año.
Lo
que han hecho los expertos es trabajar con una información ya conocida: sabíamos,
explicaron, que una proteína llamada glicoproteína F presente en la membrana
del VRS es la diana de los anticuerpos en su estado de pre-fusión (cuando está
en su superficie viral), pero no en su estado de post-fusión (tras la entrada a
la célula). Así, los investigadores han manipulado una localización determinada
en la estructura de la pre-fusión de la proteína -denominada sitio antigénico
cero-, y a continuación probaron su compuesto en ratones y macacos. El objetivo
era inmunizar a los animales para ver cuál de las proteínas F mutantes (que actúan
como antígenos) generaba la mejor respuesta protectora. Los resultados fueron
claros: la inmunización con una estructura de pre-fusión en el sitio antigénico
cero produjo hasta 10 veces más anticuerpos que la inmunización con la
glicoproteína de post- fusión, la que actualmente se emplean en la vacuna
candidata líder de para este virus que ya está en ensayos clínicos. Todavía hay
que hacer ensayos clínicos en humanos, pero los investigadores esperan tener un
producto listo para la prueba en 18 meses.
Otros
tres estudios publicados este otoño ha empleado estrategias similares para diseñar
una vacuna para otra infección intratable, el VIH. Ahora que la biología
estructural ha demostrado su valor para el diseño de vacunas, muchos
investigadores esperan que sirva para diseñar vacunas para la hepatitis C, el
dengue o el virus del Nilo Occidental.
¿Para
qué dormimos?
Este
año los neurocientíficos han dado un gran paso para saber qué pasa cuándo
dormimos. En estudios realizados en ratones se ha visto que el cerebro se
limpia a sí mismo -al expandir canales entre neuronas y permitir así que fluya
más líquido cerebroespinal-. Es decir, el cerebro «limpia» la basura que hay
mientras dormimos. Si la investigación encuentra que muchas otras especies se
someten a este servicio de «limpieza cerebral», se demostraría así que la «limpieza»
es de hecho una función básica del sueño. Los nuevos hallazgos también sugieren
que la privación de sueño puede desempeñar un papel en el desarrollo de
enfermedades neurológicas.
Una
ventana al cerebro
Una
nueva ventana para ver lo que pasa en el cerebro se ha abierto en 2013 y puede
cambiar fundamentalmente la forma en la que los laboratorios estudian este órgano
tan complejo. Esta técnica de generación de imagen, que vuelve el tejido
cerebral transparente y visualiza a las neuronas (así como a otras células
cerebrales) en pleno despliegue, cambió la manera en que los investigadores ven
a este intricado órgano. Patologías como el alzhéimer podrán beneficiarse de
este adelanto.
Nuestros
microbios, nuestra salud
Cien
billones de células con 3 millones de genes diferentes: esa es la lista de
microbios que viven dentro de nuestro cuerpo. No son sólo nuestros residentes,
sino que es posible que afecten profundamente a la respuesta del cuerpo al
medioambiente, la enfermedad y el tratamiento médico. Este año, los
investigadores comenzaron a identificar las formas específicas por las que el
microbioma promueve la salud y la enfermedad. Por ejemplo, se ha demostrado que
tres tratamientos contra el cáncer necesitan bacterias del intestino para ser
eficaces, ya que ayudan a preparar al sistema inmune para responder al
tratamiento. Estos estudios hacen cada vez más evidente que la medicina
personalizada tendrá que tener en cuente a nuestros huéspedes microbianos para
ser más eficaz
Ref:
Haz click aquí
No hay comentarios:
Publicar un comentario